In questo articolo illustro tutto quello che deve sapere in tema di dispositivi medici chi gestisce lo studio dentistico.
Il mondo dei dispositivi medici è un mondo particolarmente complesso da gestire. Il Regolamento Europeo 2017/745 ha disciplinato principalmente la sicurezza del prodotto, del processo di produzione e distribuzione ed il livello di rischio nell’utilizzo e/o applicazione dei dispositivi.
Gli ambiti da gestire in una struttura odontoiatrica sono principalmente tre:
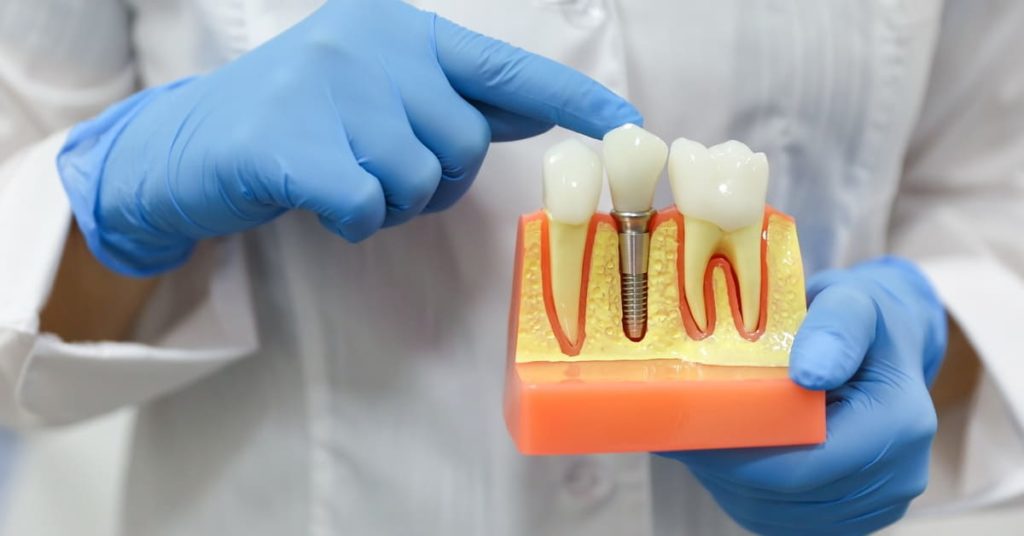
- I dispositivi medici impiantabili, ovvero “qualsiasi dispositivo, compresi quelli che sono parzialmente o interamente assorbiti, destinato a essere impiantato totalmente nel corpo umano, oppure sostituire una superficie epiteliale o la superficie oculare, mediante intervento clinico e a rimanere in tale sede dopo l’intervento. È considerato un dispositivo impiantabile anche qualsiasi dispositivo destinato a essere introdotto parzialmente nel corpo umano mediante intervento clinico e a rimanere in tale sede dopo l’intervento per un periodo di almeno 30 giorni”;
- I dispositivi medici su misura, (prodotti “in House” o da laboratori esterni), i dispositivi medici adattabili (dispositivi prodotti in serie adattati nel punto di cura) e i dispositivi medici paziente specifici, ovvero i dispositivi prodotti in serie ma realizzati su progetti digitali di trattamento e cura realizzati del professionista sanitario.
- L’approccio alla gestione di tutti i dispositivi medici presenti in una struttura odontoiatrica.
Sono dispositivi medici impiantabili gli impianti endossei, le membrane riassorbili o non riassorbibili rimosse dopo 30 giorni, i riempiti ossei, i prodotti emostatici topici riassorbibili.
Sono dispositivi medici su misura tutti i prodotti dei laboratori odontotecnici (prodotti odontoiatrici, gnatologici, ortodontici, o di supporto alla chirurgia come le dime), sono dispositivi medici su misura prodotti in house gli elementi dentali provvisori realizzati in modo estemporaneo su impronta e modello, bite, dime, mascherine con varie funzioni, corone ponti e faccette e in generale le lavorazioni il cui completo flusso digitale (rilevazione, progettazione e stampa) è realizzato in studio.
Sono dispositivi medici adattabili i dispositivi medici prodotti in serie e adattati all’anatomia del paziente direttamente in studio, come le corone preformate in resina, le maschere di Delaire, le trazioni extra orali, i bandaggi indiretti e tutti i dispositivi medici prodotti in serie che richiedono un adattamento all’anatomia del paziente per la loro efficacia o applicazione.
Sono dispositivi medici paziente specifici i dispositivi che vengono prodotti in serie esternamente ma sono basati su progetti di trattamento e cura realizzati dal sanitario.
Sono due le norme che disciplinano l’obbligatorietà e le modalità di rispetto del Regolamento Europeo e sono rispettivamente: il D. Lgs n.137/2022 entrato in vigore il 28 settembre 2022 e il Decreto del Ministero della Salute del 11 maggio 2023 che troverà applicazione da gennaio 2024.
Ogni struttura odontoiatrica che realizza al suo interno dispositivi medici su misura deve realizzare un fascicolo tecnico conforme alle richieste dell’art. 5 del Regolamento Europeo 2017/745 (vedi anche Manuale Regolamento Europeo), prevista una sanzione per i trasgressori che può andare da 24.200€ a 145.000€ (art. 27 comma1 D.Lgs 137/2022) e da gennaio 2024 ogni struttura o operatore sanitario dovrà tracciare parte del ciclo di vita dei dispostivi impiantabili (ovvero impianti endossei membrane ecc.), prevista una sanzione per la mancata registrazione e conservazione degli UDI dei dispositivi medici impiantabili di classe III forniti o ricevuti che va da 4000€ a 24,500€ (art. 27 comma 30 D.Lgs 137/2022)
L’obiettivo del regolamento è di avere sotto controllo la sicurezza dei dispositivi medici in tutto il loro ciclo di vita, di garantire la sicurezza degli operatori e dei pazienti e che ogni operatore sanitario o struttura sanitaria abbia un adeguato livello di gestione del rischio. È questo il cambio di approccio richiesto per la gestione dei dispositivi medici: chi si occupa di organizzazione e gestione deve conoscere le norme che impattano sull’attività clinica e deve attivarsi per avere i processi di gestione e il livello di rischio sotto controllo.
Per approfondire…
Anche di questo si parlerà nel Corso per Office Manager di Strutture Odontoiatriche che si terrà a Roma il 13/14 ottobre ed il 10/11 novembre.
L’obiettivo del corso è di fornire ai partecipanti le conoscenze necessarie per gestire il ruolo o la funzione di Office Manager e la visione completa degli adempimenti che impattano sull’attività clinica dei professionisti e degli operatori sanitari.
Trovi il programma e le modalità di iscrizione qui.